Влияние пептидного биорегулятора сосудов на микроциркуляцию в коре головного мозга старых крыс с артериальной гипертензией
Исследование микроциркуляции в головном мозге выявило, что после курсового применения пептидного биорегулятора сосудов у спонтанно гипертензивных крыc увеличивалась (примерно в 1,7 раза) плотность микрососудистой сети пиальной оболочки и достоверно возрастал уровень перфузии и сатурации кислородом в ткани коры головного мозга по сравнению с показателями у интактных
УСПЕХИ ГЕРОНТОЛОГИИ • 2017 • Т. 30 • № 4
© Коллектив авторов, 2017
Успехи геронтол. 2017. Т. 30. № 4. С. 534–537
УДК 577.15.04:612.135:611.813.1:599.323.4
И. Б. Соколова1, И. В. Сергеев1, Г. А. Рыжак2, В. Х. Хавинсон1, 2, Л. С. Козина2
ВЛИЯНИЕ ПЕПТИДНОГО БИОРЕГУЛЯТОРА СОСУДОВ НА МИКРОЦИРКУЛЯЦИЮ В КОРЕ ГОЛОВНОГО МОЗГА СТАРЫХ КРЫС С АРТЕРИАЛЬНОЙ ГИПЕРТЕНЗИЕЙ
1 Институт физиологии им. И. П. Павлова РАН, 199034, Санкт-Петербург, наб. Макарова, 6. e-mail: sib@kolt.infran.ru;
2 Санкт-Петербургский институт биорегуляции и геронтологии, 197110, Санкт-Петербург, пр. Динамо, 3
С помощью телевизионной установки для прижизненного исследования микроциркуляции в головном мозге выявлено, что после курсового применения пептидного биорегулятора сосудов у спонтанно гипертензивных крыc в возрасте 12 мес линии SHR увеличивалась (примерно в 1,7 раза) плотность микрососудистой сети пиальной оболочки и достоверно возрастал уровень перфузии и сатурации кислородом в ткани коры головного мозга по сравнению с показателями у интактных животных SHR той же возрастной категории.
Ключевые слова: гипертензия, плотность микрососудистой сети, преждевременное старение, ангиогенез, микроциркуляция, артерии
Артериальная гипертензия — одно из наиболее распространенных заболеваний, которое приводит к резкому нарушению мозгового кровообращения — инсульту. Но даже при умеренном перманентном повышении АД происходит поражение мелких церебральных артерий и артериол (гипертоническая ангиопатия). В результате этого развиваются такие заболевания, как лакунарные инфаркты головного мозга, а с течением времени формируется сосудистая (дисциркуляторная) энцефалопатия [4, 12, 16]. Разработка новых препаратов для активации ангиогенеза в головном мозге у больных с артериальная гипертензией — актуальная задача современной биологии и медицины. Установлено, что пептидный биорегулятор сосудов «Славинорм» оказывает тканеспецифическое действие, стимулируя рост эксплантатов ткани сосудов молодых и старых крыс в органотипических культурах [9, 15, 17]. Курсовое введение Славинорма старым (2 года) нормотензивным крысам линии Wistar—Kyoto привело к значительному повышению плотности микрососудистой сети в коре головного мозга [8].
Цель данной работы — изучение влияния пептидного биорегулятора сосудов на основные показатели микроциркуляции (плотность микрососудистого русла, перфузию, тканевую сатурацию кислородом) в коре головного мозга у старых спонтанно гипертензивных крыс линии SHR, сравнение данных показателей с таковыми у нормотензивных животных линии Wistar—Kyoto той же возрастной категории.
Материалы и методы
Работа выполнена с использованием животных из биоколлекции ИФ РАН. Эксперименты проведены на спонтанно гипертензивных крысах самцах линии SHR. Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище. Исследования провод или в соответствии с «Правилами проведения работ с использованием экспериментальных животных», принятыми Европейской конвенцией 19.07.2014. Пептидный биорегулятор сосудов «Славинорм» находится в разработке в Санкт-Петербургском институте биорегуляции и геронтологии. Славинорм представляет собой комплекс полипептидов с молекулярной массой 72–678 Да, экстрагированных из сосудов телят. Для экспериментального исследования было сформировано три группы из 12-месяных животных: 1-я (n=19) — интактные крысы линии SHR; 2-я (n=12) — крысы линии SHR, которым за 2 мес до исследования был проведен один курс пептидного биорегулятора сосудов «Славинорм»; 3-я (контрольная, n=10) — нормотензивные крысы линии Wistar–Kyoto. Введение препарата «Славинорм» в дозе 0,25 мг на крысу гипертензивным животным 12 мес осуществляли внутримышечно по схеме: одна инъекция в сутки в течение 5 дней, перерыв 2 сут и т. д. (всего 10 инъекций). Визуализацию, мониторинг микрососудистой сети, измерение скорости кровотока и сатурации крови в ткани сенсомоторной зоны коры головного мозга проводили через 2 мес после курсового введения Славинорма. Крыс наркотизировали золетилом (международное непатентованное наименование действующих веществ: тилетамин, золазепам, «Virbac», Франция) — 20 мг/кг интраперитонеально [14]. Затем удаляли теменную кость и твердую мозговую оболочку, тем самым позволяя визуализировать пиальную оболочку сенсомоторной коры. Поверхность мозга непрерывно орошали физиологическим раствором при температуре 37 °C [20].
Для определения плотности микрососудистой сети животных помещали под объектив стереоскопического микроскопа «МС-2 ZOOM» («Микромед», Россия), куда была установлена цифровая видеокамера «DCM-510» («Scopetek», Китай). Общее увеличение всей оптической системы составляло 40 крат. Полученные изображения пиальной оболочки коры головного мозга животных фиксировались в памяти компьютера. Используя компьютерную программу «Photo M», на статических изображениях подсчитывали общее число сосудов и отдельно артерий на единицу площади.
Для измерения уровня перфузии и сатурации кислородом (SO2) в сенсомоторной зоне коры головного мозга использовали комплекс многофункциональной лазерной диагностики «ЛАКК-М» (НПП «Лазма», Россия). Данный комплекс определяет динамическую характеристику микроциркуляции крови — перфузию — изменение потока крови в единицу времени в исследуемом объеме ткани (около 1 мм3) в относительных перфузионных единицах методом лазерной допплеровской флуометрии. С помощью того же прибора методом оптической тканевой оксиметрии оценивали SO2 в этом же объеме ткани коры головного мозга. Исходно в стандартных условиях перфузию и SO2 регистрировали на поверхности каждого полушария в четырех точках с приблизительными координатами АР=1, 2, 3, 4 мм от брегмы; SD=1 мм латерально от сагиттального шва. Ректальную температуру животных, измеряемую с помощью термометра, в течение всего опыта поддерживали на уровне 37 °C. САД измеряли с помощью устройства для неинвазивного измерения АД у не наркотизированных крыс, изготовленного в экспериментальных мастерских Института физиологии им. И. П. Пав лова РАН; у гипертензивных крыс в возрасте 12 мес САД в среднем составляло 191±2,1 мм рт. ст., у нормотензивных животных того же возраста — 139±3 мм рт. ст. При статистической обработке всех данных достоверность различий оценивали с помощью критерия Манна—Уитни [2], уровень достоверности различий p<0,05. Математическая обработка проведена в Excel.
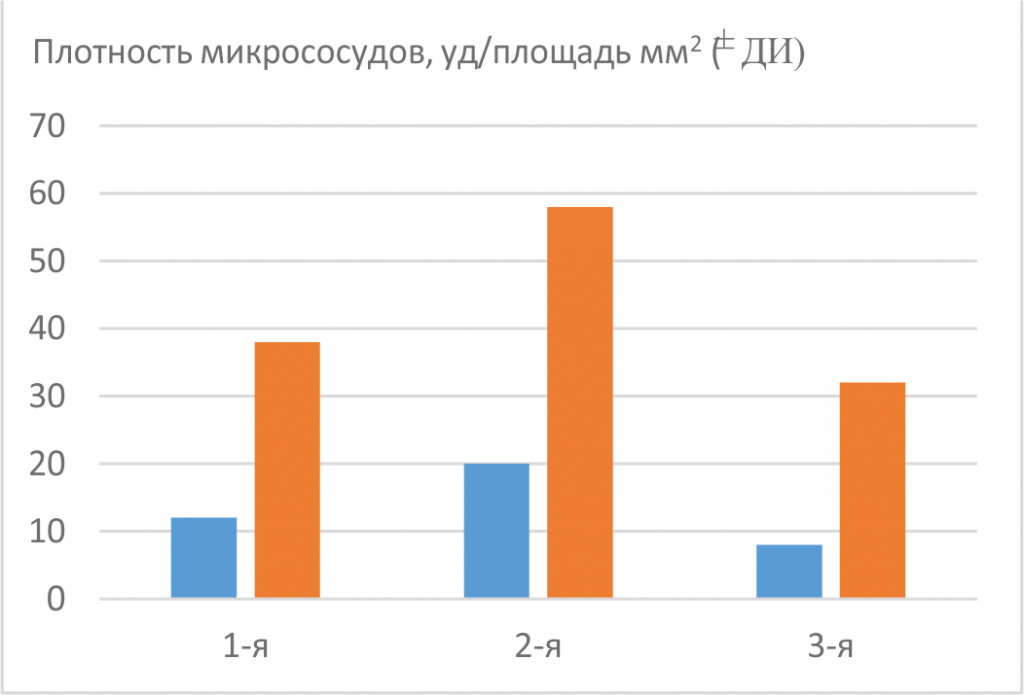
Рис. 1. Плотность микрососудистой сети пиальной оболочки сенсомоторной коры у 12-месячных крыс исследованных групп. Темные столбики — плотность артерий в пиальной оболочке сенсомоторной коры головного мозга, * p<0,05 — статистически значимые различия между этими показателями; светлые столбики — плотность всей микрососудистой сети пиальной оболочки сенсомоторной коры головного мозга, ** p<0,05 — статистически значимые различия между этими показателями
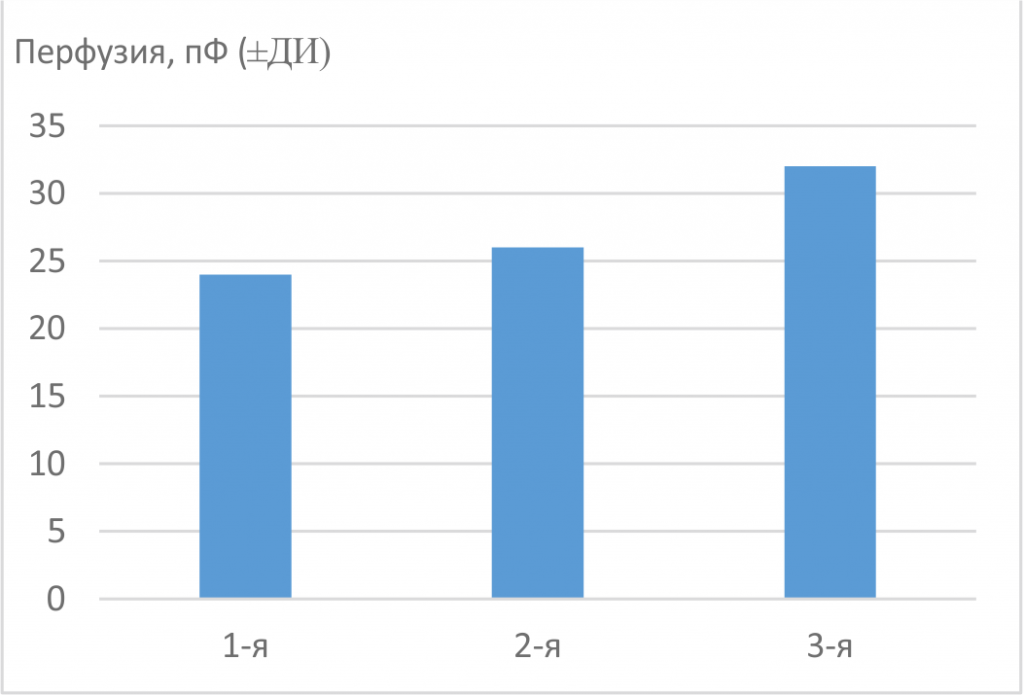
Рис. 2. Сатурация кислородом ткани сенсомоторной коры головного мозга у 12-месячных крыс исследованных групп. *(p<0,05) — статистически значимые различия между показателями
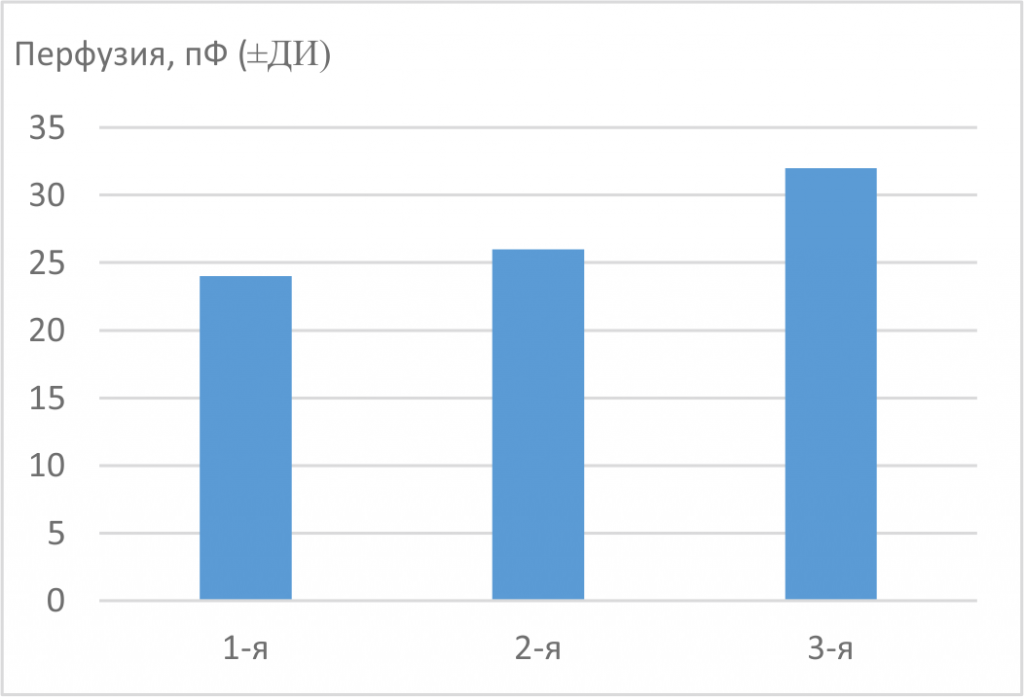
Рис. 3. Перфузия в ткани сенсомоторной коры головного мозга у 12-месячных крыс исследованных групп. * p<0,05 — статистически значимые различия между показателями
Результаты и обсуждение
В представленной работе мы рассматриваем спонтанно гипертензивных крыс в возрасте 12 мес линии SHR как старых животных в связи со следующими обстоятельствами: крысы линии SHR уже в возрасте 4 мес имели низкую плотность микрососудистой сети, уровень тканевой перфузии и сатурации кислородом по этим показателям мозговой микроциркуляции соответствовали нормотензивным животным в возрасте 22– 24 мес линии Wistar—Kyoto [6].
По мере старения до 12 мес у крыс линии SHR был выявлен компенсаторный ангиогенез, вызванный ишемией ткани головного мозга [19]: плотность всей микрососудистой сети увеличилась в 1,2 раза (статистически недостоверно), а число артерий и артериол на единицу площади пиальной оболочки сенсомоторной коры — в 1,3 раза (статистически недостоверно) по сравнению с крысами в возрасте 4 мес линии SHR. В результате этого у 12-месячных гипертензивных (1-я экспериментальная группа) и нормотензивных (3-я группа, контрольная) крыс плотность микрососудистой сети пиальной оболочки сенсомоторной коры и плотность артерий на том же тканевом участке была примерно одинаковой (рис. 1).
После курсового введения Славинорма (2-я экс периментальная группа) плотность микрососудистой сети пиальной оболочки сенсомоторной коры у крыс повысилась в 1,7–1,8 раза по сравнению с животными 1-й и 3-й групп, соответственно. Число артерий и артериол на единицу площади при этом возросло в 1,7–2,3 раза, соответственно (см. рис. 1). Значительное увеличение плотности микрососудистой сети, возможно, позволит предотвратить сосудистое запустевание ткани головного мозга, которое происходит по мере старения животных [7]. Очень важно, что после применения Славинорма в ткани коры головного мозга активировался не только ангогенез, но и артериогенез, так как при артериальной гипертензии в первую очередь происходит ремоделинг именно артериальных микрососудов [13]. Увеличение числа артерий и артериол положительно влияет на снабжение ткани головного мозга кислородом, так как на уровне этих сосудов происходит около 30 % газообмена между кровью и тканью мозга [18]. Увеличение доли артериальных сосудов привело к увеличению объема артериальной крови с более высоким, чем у венозной крови, уровнем SO2 в исследуемом объеме ткани коры головного мозга. В результате, мы получили статистически достоверный подъем сатурации кислородом ткани сенсомоторной коры после одного курса Славинорма (рис. 2). Рост насыщения ткани головного мозга кислородом у гипертензивных животных, имеющих повышенную адренореактивность мозговых артерий [3], способствует тому, что клетки мозга легче перенесут спазм мозговых сосудов.
О возрастном ухудшении микроциркуляции в сенсомоторной коре головного мозга мы можем судить по динамической характеристике кров отока — перфузии (рис. 3). Её уровень в сенсомоторной коре у интактных 12-месячных крыс линии SHR примерно в 1,3 раза ниже (статистически достоверно), чем у нормотензивных животных контрольной группы. Ранее было выявлено, что артериальная гипертензия приводит к понижению скорости кровотока в различных структурах головного мозга [10, 11].
В данном исследовании мы показали, что с помощью одного курса пептидного биорегулятора сосудов возможно повысить уровень перфузии у старых гипертензивных крыс (см. рис. 3). Однако такая схема применения Славинорма не позволила восстановить перфузию у 12-месячных крыс линии SHR до уровня у нормотензивных крыс Wistar—Kyoto того же возраста. Повышение уровня перфузии может быть связано с ослаблением артериального сосудистого тонуса [1, 5] и приводит к увеличению объема крови в артериях и, следовательно, к улучшению снабжения ткани мозга кислородом.
Заключение
Итак, курсовое применение пептидного биорегулятора сосудов «Славинорм» старым спонтанно гипертензивным крысам позволило увеличить плотность микрососудистой сети пиальной оболочки и сатурацию кислородом ткани сенсомоторной коры выше уровня у нормотензивных животных той же возрастной категории. При этом повысилась и перфузия в сенсомоторной коре, но этот показатель не достиг уровня нормотензивных животных. Исходя из полученных результатов, мы полагаем, что при артериальной гипертензии возможно улучшить микроциркуляцию в головном мозге с помощью пептидного биорегулятора сосудов.
Литература
1. Бархатов И. В. Применение лазерной допплеровской флуометрии для оценки нарушений системы микроциркуляции крови человека // Казан. мед. журн. 2014. Т. 45. № 1. С. 63–69.
2. Гланц С. Микробиологическая статистика. М.: Практика, 1999.
3. Дворецкий Д. П., Рыжикова О. П., Шуваева В. П. Сравнительная характеристика адренореактивности пиальных артериальных сосудов у нормотензивных и спонтанно гипертензивных крыс // Регионарное кровообращение и микроциркуляция. 2002. № 2. С. 75–81.
4. Калашникова Л. А. Артериальная гипертония и ишемические нарушения мозгового кровообращения // Нервы. 2009. № 1. С. 4–6.
5. Рогаткин Д. А. Физические основы оптической оксиметрии // Мед. физика. 2012. № 2. С. 97–114.
6. Соколова И. Б., Сергеев И. В., Дворецкий Д. П. Влияние повышенного артериального давления на микроциркуляцию в коре головного мозга молодых крыс // Бюл. экспер. биол. 2015. Т. 160. № 9. С. 276–284.
7. Соколова И. Б., Сергеев И. В., Федотова О. Р., Дворецкий Д. П. Возрастные изменения микроциркуляции в пиальной оболочке сенсомоторной коры головного мозга крыс // Успехи геронтол. 2013. Т. 26. № 3. С. 437–441.
8. Соколова И. Б., Рыжак Г. А., Мельникова Н. Н. и др. Влияние пептидного биорегулятора сосудов на плотность микрососудистой сети коры головного мозга старых крыс // Бюл. экспер. биол. 2016. Т. 161. № 2. С. 266–270.
9. Хавинсон В. Х., Кузник Б. И., Рыжак Г. А. Пептидные геропротекторы — эпигенетические регуляторы физиологических функций организма. СПб.: РГПУ им. А. И. Герцена, 2014.
10. Beason-Held L., Moghekar A., Zonderman A. et al. Longitudinal changes in cerebral blood fl ow in the older hypertensive brain // Stroke. 2007. № 38. P. 1766–1773.
11. Dai W., Lopez O., Carmichael O. et al. Abnormal regional cerebral blood fl ow in cognitively normal elderly subjects with hypertension // Stroke. 2008. № 39. P. 349–354.
12. Dahlof B. Prevention of stroke in patients with hypertension // Amer. J. Cardiol. 2007. № 50. P. 14–24.
13. Eccleston-Joyner C., Gray S. Arterial hypertrophy in the fetal and neonatal spontaneously hypertensive rat // Hypertension. 1988. № 12. P. 513–518.
14. Ferrari L., Turrini G., Rostello C. et al. Evaluation of two combinations of Domitor, Zoletil100, and Euthatal to obtain longterm nonrecovery anesthesia in Spregue-Dawley rats // Comparative med. 2005. Vol. 55. № 3. P. 256–264.
15. Khavinson V. Kh., Kuznik B. I., Ryzhak G. A. Peptide bioregulators: a new class of geroprotectors. Message 1: results of experimental studies // Adv. geront. 2013. Vol. 3. № 3. P. 225–235.
16. Lammie G. Hypertensive cerebral small vessel disease and stroke // Brain Pathol. 2002. № 12. P. 358–370.
17. Ryzhak A. P., Kuznik B. I., Rutkovskaya V. N., Ryzhak G. A. The antiatherosclerotic effects of a geroprotector peptide // Adv. Geront. 2012. Vol. 2. № 4. P. 332–335.
18. Tsai A., Johnson P., Intaglietta M. Oxygen gradients in the microcirculation // Physiol. Rev. 2003. № 83. P. 933–963.
19. Vilar J., Waeckel L., Bonnin P. et al. Chronic hypoxia-induced angiogenesis normalized blood pressure in spontaneously hypertensive rats // Circulation res. 2008. № 103. P. 761–769.
20. Waynforth H. Experimental and surgical technique in the rat. Academic press, 1980